En los años 90, unos pocos científicos audaces comenzaron a desarrollar una tecnología en la que entonces era muy difícil creer por diversos motivos: vacunas de ARN. Lograron superar enormes obstáculos técnicos y demostrar que funcionaban en animales. La pandemia de COVID-19 supuso un impulso inesperado a esta nueva tecnología que de otro modo habría tardado mucho más en madurar, y sus resultados han sido brillantes; solo en el primer año de vacunación, las inmunizaciones contra la COVID-19 salvaron 20 millones de vidas. Hoy esta tecnología se está extendiendo a otros frentes contra la enfermedad, demostrando cómo las técnicas basadas en los genes aún tienen muchas soluciones que ofrecernos.
Desde que en 1796 el inglés Edward Jenner comenzó a ensayar su vacuna contra la viruela, siguiendo otros trabajos pioneros, unos 530 millones de personas se han librado de morir por esta enfermedad, según una estimación. A ello hay que añadir los incontables millones de vidas que han salvado y hoy salvan otras vacunas; hasta cinco millones al año, según la Organización Mundial de la Salud. A lo largo de la historia han sido varios los enfoques técnicos utilizados para preparar la respuesta inmune del organismo contra las infecciones: en una primera época, patógenos atenuados o inactivados, o fragmentos de ellos. Más adelante, con el desarrollo de la biología molecular, pudieron fabricarse in vitro componentes del patógeno, o bien construirse vectores recombinantes, vehículos como virus inofensivos en los que se introducen partes o materiales genéticos del patógeno.
La clave: el ARN mensajero
Las vacunas de vector viral se basan en la idea de que sea el propio organismo el que fabrique su vacuna; se suministra un ADN del virus que incluye el gen para crear alguna proteína viral, o antígeno. Cuando las células de la persona vacunada toman este ADN y lo utilizan para producir dicha proteína, el sistema inmune la reconoce como extraña y dispara una respuesta. Una variante son las llamadas vacunas de ADN. El principio es similar, pero en este caso no se utiliza un vehículo viral, sino que el ADN se introduce por otros métodos; por ejemplo, encapsulado en liposomas, diminutas vesículas de grasa. En un caso u otro, una ventaja de estas estrategias es que la producción del antígeno en las propias células no solo induce la producción de anticuerpos, sino que también estimula la otra mitad del sistema inmune, la respuesta celular mediada por los linfocitos T.
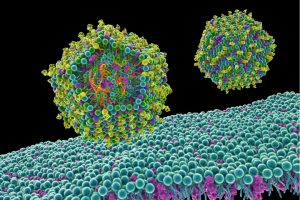
En la década de 1980 varios investigadores comenzaron a experimentar con la opción de introducir ARN en las células, en principio con vistas a desarrollar una especie de terapia génica sin genes. La terapia génica busca corregir un gen defectuoso aportando una versión sana, sobre todo en las enfermedades congénitas. La posibilidad de utilizar ARN mensajero, el intermediario desechable copiado del ADN que traduce los genes a proteínas, ofrecía ventajas interesantes añadidas al uso de ADN: no era necesario introducirlo en el núcleo celular, ya que el ARN se traduce en el citoplasma, la parte de la célula exterior al núcleo; y por la misma razón, no hay riesgo de que se integre en los cromosomas con posibles efectos no deseados.
Pero al mismo tiempo, parecía una empresa casi imposible: el ARN se degrada muy fácilmente, y además el sistema inmune lo eliminaba por considerarlo una amenaza extraña. A comienzos de este siglo, la bioquímica húngara Katalin Karikó y el inmunólogo estadounidense Drew Weissman, junto con otros investigadores, superaron estas dificultades, envolviendo el ARN en nanopartículas de lípidos y modificándolo para que no fuera destruido.

La tecnología de vacunas de ARN solo estuvo madura en la década de 2010, pero ya entonces demostró su validez en animales de laboratorio. Y fue providencial durante la pandemia. Una cualidad esencial de estas vacunas es que pueden adaptarse rápidamente contra cualquier nuevo patógeno simplemente conociendo su genoma, lo que permitió crear, ensayar y desplegar las vacunas de ARN de BioNTech-Pfizer y Moderna contra la COVID-19 en tiempo récord. El inmenso éxito de estas inmunizaciones y lo que aportaron en la lucha contra la pandemia merecieron el Nobel de Fisiología o Medicina para Karikó y Weissman en 2023.
Del ARN al CRISPR
Después de este hito, que impulsó y consolidó la tecnología, las vacunas de ARN han continuado explorándose para otros fines: distintas enfermedades infecciosas como gripe, herpes, Virus Respiratorio Sincitial y otras, terapia génica —su propósito original—, vacunas contra cánceres tan letales como el de páncreas o el melanoma, e incluso enfermedades cardíacas, neurodegenerativas u óseas.

El progreso del ARN como herramienta terapéutica ha motivado también el nacimiento de un nuevo campo: la edición de ARN como alternativa al uso de CRISPR. Este sistema de corta-pega de genes se está abriendo camino en la terapia génica, pero presenta posibles inconvenientes: modificar los genes incurre en el riesgo de introducir cambios en lugares no deseados del genoma. En su lugar, distintos grupos de investigación ensayan la edición de ARN, que al ser un intermediario desechable en la producción de proteínas evita el riesgo de alteraciones permanentes. Ya hay tres ensayos clínicos aprobados o en marcha utilizando esta tecnología contra dos enfermedades genéticas (deficiencia de alfa-1 antitripsina y enfermedad de Stargardt) y el tipo más común de cáncer de hígado, carcinoma hepatocelular.
Es más, la facilidad y rapidez en la adaptación de los fármacos basados en el ARN a cada necesidad concreta convierte ahora a estas herramientas en una gran esperanza para la medicina personalizada, capaz de producir medicamentos, por ejemplo, específicos contra el cáncer de un paciente concreto. La medicina del ARN apenas está empezando a desplegar todo su potencial.
Comentarios sobre esta publicación